Variation de l'enthalpie associée à une réaction chimique
Une réaction chimique est généralement accompagnée de variation d'enthalpie. Celle-ci joue un rôle important aussi bien pour le bilan énergétique du système que pour le calcul de son état d'équilibre. On désigne par l'enthalpie de la réaction la variation d'enthalpie lors de la transformation complète des réactifs (état initial) en produits (état final) conformément à la stoechiométrie de la réaction. L'enthalpie de la réaction dépend donc de l'écriture de l'équation-bilan mais il est préférable, pour enlever toute ambiguïté, de l'exprimer par rapport à la variation d'un réactif clé.
2A + 3B = 2R (ΔH= 2000 J)
A + 1,5B = R (ΔH= 1000 J)
Mais dans tous les cas ΔH=1000 J/mol de A)
L'enthalpie d'une réaction peut être mesurée expérimentalement par des techniques calorimétriques. Elle peut aussi être calculée, sans avoir recours à l'expérience, en appliquant la propriété d'additivité des enthalpies, énoncée en 1840 par Germain Henri Hess donnant lieu à une loi portant son nom.
La variation d'enthalpie d'une réaction est toujours la même, que cette réaction se produise en une ou plusieurs étapes.
Cette loi qui peut sembler très banale voire évidente (l'enthalpie étant une fonction d'état, sa variation ne dépend que de l'état initial et final du système quel que soit le chemin parcouru) est particulièrement utile. A partir de cette règle, il est en effet possible de déterminer l'enthalpie d'une réaction donnée en suivant des chemins faisant intervenir des réactions dont l'enthalpie est connue. Ces dernières peuvent être sans le moindre lien avec le mécanisme supposé de la réaction voire s'avérer complètement utopiques, qu'importe dès moments que leur combinaison linéaire permet d'aboutir à l'éqution-bilan recherchée. Dans la pratique, on choisi les réactions de base les plus simples possible c'està- dire celles qui correspondent à la transformations des éléments en différents corps composés. De surcroît, comme la valeur de l'enthalpie dépend des conditions de pression et de température, celle-ci est exprimée dans les conditions de références qui sont celles de l'état standard. Dans ces conditions, la variation de l'enthalpie du système est appelée l'enthalpie standard de formation :
Enthalpie molaire standard de formation, ΔH°f d'un corps composé est la variation d'enthalpie de réaction par laquelle il se forme une mole de ce composé dans l'état standard à partir de corps simples (éléments) exclusivement pris eux aussi à l'état standard. Cet état standard correspond à l'état physique le plus stable à P= 1 bars et T=298,15 K.
A ce stade, il n'est pas inopportun de rappeler quelques conventions nécessaires à une utilisation en bonne et due forme des valeurs données dans les tables thermodynamiques3 :
-
L'enthalpie standard de formation des éléments est nulle. Cette définition fixe l'origine de toutes les enthalpies standard de réaction
-
L'enthalpie étant une grandeur extensive, sa valeur est directement liée à la manière d'exprimer l'équation-bilan de la réaction,
-
L'enthalpie donnée correspond toujours à un sens déterminé, celui donné par l'équation bilan. L'enthalpie de la réaction inverse est, en valeur absolue, la même que celle de la réaction directe mais de signe opposé.
Chimie générale pour ingénieur, C.K.W. Friedli. Presses polytechniques et universitaires Romandes
Ainsi, il est possible en appliquant la loi de Hess, de déterminer la valeur de l'enthalpie standard de la plupart des réactions chimiques en combinant algébriquement une série de réaction de formation. Pour cela, il suffit de réaliser des combinaisons linéaires d'équations chimiques pour obtenir une réaction puis d'appliquer cette même combinaison aux enthalpies standard de formation pour obtenir l'enthalpie standard de la réaction.
Pour une réaction présentée par l'expression Σνj ⋅ Aj = 0 la loi de Hess prendra alors la forme :
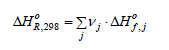
Rappelons enfin que lorsqu'on s'intéresse à l'enthalpie de la réaction dans les conditions différentes de celles de l'état standard, il faut aussi tenir compte de la variation de l'enthalpie avec la température et pression ainsi que d'éventuelle enthalpies de changement d'état. Pour le système réactionnel Σjvj . Aj = 0 l'enthalpie de la réaction dans les conditions quelconques s'écrit :
où hT,j représente l'enthalpie molaire partielle du corps Aj à la température T. En négligeant la contribution de la chaleur de mélange ainsi que celle liée à la différence de pression entre l'état de référence et les conditions réelles, ce paramètre peut être considéré comme la somme des trois contributions suivantes :
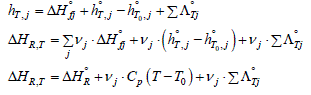
avec :
-
ΔH°fj : enthalpie standard de formation de l'espèce Aj à la température de référence (298 K)
-
h°T , j - hT0 , j : variation d'enthalpie standard entre la température de référence T0 et la température T sans changement d'état
-
ΣΛ°Tj : enthalpie de changement d'état appelée aussi la chaleur latente. Ce terme doit tenir compte de l'ensemble des changement d'état que le corps Aj doit subir pour être amené de l'état de référence à son état réel dans les conditions de déroulement de la réaction (évaporation, condensation, congélation, fusion, sublimation, etc.).
Très généralement, la chaleur latente des transformations physiques n'est connue qu'à la température correspondante à cette transformation sous la pression atmosphérique (et non pas dans les conditions standards). Ainsi, le calcul de ???
