Paramètres associés à la composition d'un mélange réactionnel et à son évolution.
Le calcul d'un réacteur nécessite la définition, au préalable, des grandeurs permettant de décrire quantitativement l'état du mélange réactionnel. Etant donné que les réactions chimiques mettent en jeu des transformations de molécules, les grandeurs que nous utiliserons seront des grandeurs molaires. Elles s'appliquent aussi bien à un milieu homogène, c-à-d à une phase bien définie, qu'à des milieux polyphasiques lorsqu'ils peuvent être considérés comme un mélange pseudo-homogène avec des propriétés moyennes. Parmi de nombreux paramètres qui peuvent être utilisés pour décrire la composition de tels systèmes, nous retenons les suivants :
-
Le nombre de mole : N j pour un système fermé ou le débit molaire Fj pour un système ouvert.
-
Les concentrations molaires : C'est la seule concentration que nous utiliserons et que nous appelons concentration. Pour un système fermé Cj = Nj/V et pour un système ouvert Cj = Fj/Q où V est le volume instantané et Q le débit volumique instantané.
-
Les titres molaires : xj pour la phase liquide et yj pour la phase gazeuse : pour un système fermé xj (yj) = Nj/NT où NT est le nombre de moles total et pour un système ouvert xj (yj) = Fj/FT ou FT est le débit molaire total.
-
La pression partielle pj: utilisée pour les mélanges gazeux. Pour un gaz parfait ce paramètre peut être lié à la concentration ou au titre molaire par pj=P.yj=CjRT.
Par ailleurs, pour un système siège d'une réaction chimique, il est incontournable de définir des paramètres permettant de relier la composition du mélange réactionnel à tout instant à celle de l'instant initial ou l'état de référence.
Réaction simple en système fermé
Commençons par le cas où une réaction à stoechiométrie simple (définie par la relation 1.1) se déroule en système fermé. L'évolution d'un tel système peut être suivie par le paramètre avancement, ξ, défini tel que :
L'indice 0 se réfère à l'état initial du système. Le lecteur peut facilement vérifier qu'ainsi défini, le bilan de matière imposé par la relation stoechiométrique est respecté. Cependant, la variable avancement présente deux inconvénients majeurs : d'une part, elle n'est pas sans dimension et, d'autre part, sa valeur dépend de la quantité initiale de réactifs. Afin de palier ce problème, il est également possible d'exprimer l'évolution de la composition en suivant la variation d'un constituant clé Ai. Ainsi, on définit, XA, le taux de conversion du réactif clé A, comme la fraction de la quantité initiale de celui-ci transformée au cours de la réaction :
Le taux de conversion est un nombre sans dimension, ce qui constitue un avantage pour les applications d'ingénierie, mais il a l'inconvénient d'être attaché à un réactif particulier. De ce fait, le choix du réactif clé prend un rôle essentiel et doit être effectué de manière judicieuse. Si le mélange réactionnel n'est pas stoechiométrique on choisit le réactif limitant comme réactif clé. Dans le cas contraire (mélange stoechiométrique), le choix se fait en fonction d'autres critères, par exemple le réactif qui joue un rôle particulier, le réactif le plus onéreux, etc.
Réaction simple en système ouvert
Les variables, avancement et taux de conversion, peuvent également être utilisées pour décrire l'évolution du mélange réactionnel dans les systèmes ouverts. Elles seront alors définies, de manière analogue aux systèmes fermés, par les relations suivantes :
« Fj = Fj0 +ν j ⋅ξ » (1-4 bis)
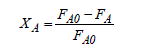
Réaction à stoechiométrie multiple
Pour les réactions complexes, qu'il s'agisse de système fermé ou ouvert, la variable avancement est généralement préférée au taux de conversion, car elle permet une mise en équation plus rationnelle du système réactionnel. Cependant, dans certains cas, où le nombre à la fois de réactions et de constituants actifs est restreint, on peut utiliser le taux de conversion associé à d'autres paramètres comme le rendement ou la sélectivité qui seront définis ultérieurement. Considérons un système caractérisé par le déroulement simultané de m réactions chimiques faisant intervenir n espèces moléculaires (voir relation 1.3).
On définit pour chaque réaction un avancement ξ i tel que :
L'évolution d'un système réactionnel doit être rapportée à un état de référence sous la pression pRef, à la température TRef et où l'avancement ou le taux de conversion sont respectivement, ξRef et XA,Ref. Il est commode et très courant de poser l'état initial du système (T0, p0, et ξA (ou XA=0)) comme l'état de référence mais ceci n'est pas une obligation. Autrement dit, l'état de référence peut être choisi de manière arbitraire dans des conditions autres que celles initiales voire même dans les conditions hypothétiques où la phase peut ne jamais exister. L'important est de se référer toujours au même état.
