Relations entre concentrations
La grande majorité des lois cinétiques que l'on utilise pour le calcul des réacteurs chimiques est exprimée en fonction de la concentration d'une ou plusieurs espèce(s) moléculaire(s) mise(s) en jeu. Or, lors d'une réaction, la concentration des espèces moléculaires varie au cours du temps. Le calcul des réacteurs nécessite donc l'établissement de relations permettant de relier, d'une part, la concentration des différents constituants entre eux et, d'autre part, la composition du système à tout stade d'évolution en fonction de la composition à l'état de référence. La concentration d'un constituant au sein d'un système peut varier soit en raison d'une modification de sa quantité, soit à cause d'une variation du volume du système. La relation entre la quantité des différents constituants peut être facilement établie à partir de l'avancement (Eqn. 1-4) ou du taux de conversion par l'équation suivante, que le lecteur peut démontrer en guise d'exercice :
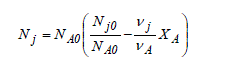
Si la variation de la quantité d'une substance dans un système fermé ne peut provenir que d'une réaction chimique, la variation du volume peut avoir des origines diverses. Tout d'abord, le volume peut varier à cause d'un changement de conditions physiques et, notamment, la température et la pression ; la loi du gaz parfait en est l'exemple type. Le changement de la nature chimique des constituants dû à la réaction peut, également, modifier le volume car, d'une part, le nombre de mole n'est pas conservé et, d'autre part, le volume spécifique des réactifs peut être différent de celui des produits auxquels ils donnent naissance. Pour des liquides, la variation de volume est négligeable, qu'il s'agisse d'effets physique ou chimique. Ceci n'et pas le cas pour les gaz, objets du reste de ce paragraphe. Soit une transformation chimique décrite par la relation (1.1) ayant lieu en phase gazeuse fermée. Au bout d'un temps t, l'avancement de la réaction est ξ, sa température T et sa pression P. En faisant l'hypothèse du gaz parfait, le volume du mélange réactionnel est :
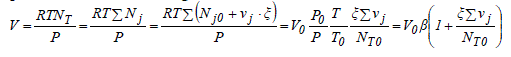
β est appelé le facteur de dilatation physique. Ce paramètre tient compte de la variation de volume du système due aux changements des conditions T et P.
Cette équation peut également être exprimée en terme de taux de conversion XA :
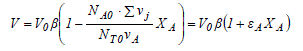
εA est appelé le facteur d'expansion chimique. L'indice A signifie que ce facteur n'est pas propre à l'équation mais attaché au réactif clé A. La variation de volume d'un système est d'autant plus grande que la valeur absolue de ce facteur est grande. Un facteur d'expansion chimique positif signifie une augmentation du volume réactionnel avec l'avancement de la réaction et vice versa. En combinant les équations (1-4) et (1-8), on obtient l'expression de la concentration du constituant actif j :
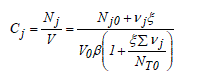
De la même manière, l'expression de la concentration peut être obtenue en terme de taux de conversion en combinant les équations (1-7) et (1-9)
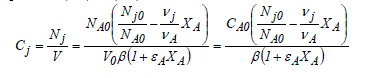
Ces équations permettent de décrire, de manière structurée, les liens entre différentes concentrations. Elles montrent que si l'on connaît la variation de la quantité de l'une des espèces moléculaires, toutes les autres peuvent s'en déduire. Notons enfin que toutes les équations présentées ici pour les systèmes fermés peuvent être utilisées pour les systèmes ouverts à condition de remplacer le nombre de mole, N, par le débit molaire, F, et le volume, V, par le débit volumique, Q. Le tableau 1.2 regroupe quelques équations utiles associées à la variation de la composition des systèmes réactionnels. Nous laissons au lecteur le soin de vérifier l'exactitude des équations dont la démonstration n'a pas été explicitée au sein de ce chapitre. Nous allons clore ce chapitre en précisant que le symbolisme que nous venons de décrire (constituant Aj,indice j) sera respecté pour tous les systèmes mettant en jeu un nombre important de constituants actifs et/ou de réactions. Toutefois, pour les cas ne faisant intervenir qu'un nombre limité de constituants, nous nous réservons le droit de désigner ces derniers par des lettres capitales A, B, C, ... et de spécifier leurs grandeurs caractéristiques par les mêmes lettres en indice, par exemple CA, FA, yB, NC, etc...

pour les liquide, les variations de volume seront négligées (β=1 et εA = 0)
