La vitesse réactionnelle
D'une manière générale, la vitesse d'une réaction chimique est une grandeur qui traduit l'allure à laquelle la composition du milieu réactionnel évolue. Cette évolution peut être si rapide qu'elle semble instantanée (l'explosion ou la combustion des hydrocarbures) ou, à l'opposé, extrêmement lente (comme la transformation de résidus fossiles en pétrole ou encore la formation du diamant). Bien entendu, la définition de la vitesse d'une réaction renvoie au choix d'un observable judicieusement choisi, symptomatique de la composition du système réactionnel. Ainsi, la vitesse réactionnelle peut être définie comme la variation de l'observable choisi en fonction du temps. Sur ce plan, l'avancement de la réaction, ξ, le taux de conversion, XA, ou encore la concentration, Cj, ou tout simplement la quantité molaire des espèces actives, NA, constituent les paramètres de choix. C'est ce dernier paramètre que nous utiliserons préférentiellement dans la suite de ce document. Cependant, il est préférable, voire indispensable, de rapporter cette variation à une grandeur caractéristique du réacteur, Z, de sorte que la vitesse devienne indépendante des dimensions du réacteur.
supposons que pour une réaction homogène quelconque réalisée dans un réacteur de 1 L le débit de production d'un composant donné soit égal à 1 mol.s-1. Ce débit de production sera deux fois plus grand si la réaction est réalisée dans un réacteur de 2 L, mais, en tout état de cause, la vitesse de la réaction sera de 1 mol.L-1.s-1.
Par conséquent, la vitesse d'une réaction chimique est définie comme la quantité molaire d'un composant de référence, Aj, qui apparaît par unité de temps et par unité de grandeur caractéristique Z choisie. Il s'agit donc d'un débit spécifique molaire de production d'un composant clé, réactif ou produit, qui prend part à la réaction :

Le choix de la grandeur caractéristique est primordial et doit être effectué judicieusement. En effet, l'utilisation de l'équation de vitesse en vue du calcul des réacteurs conduira à en déterminer la même caractéristique. Dans le cas des réactions homogène le choix de volume comme grandeur de référence s'impose de manière presque naturelle voire intuitive. Toutefois, dans le cas des réactions hétérogènes, il est parfois plus approprié d'utiliser d'autres grandeurs : la masse de catalyseur pour une réaction catalytique hétérogène, l'aire interfaciale des bulles dans un réacteur gaz-liquide, etc. Par conséquent, pour la réaction :
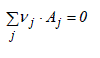
la vitesse réactionnelle s'écrit :
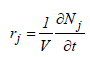
Ainsi définie, la vitesse de la réaction sera positive si le constituant clé est un produit et négative si celui-ci est un réactif. De plus, pour un système homogène en marche isochore (V=cte), l'équation précédente peut s'écrire sous la forme :
Notons enfin que la vitesse réactionnelle est une propriété intensive de la réaction, c'est-à-dire qu'elle ne dépend pas des dimensions du milieu dans lequel elle est mise en jeu.
Dans son ouvrage "Génie de la réaction chimique", J. Villermaux remarquait à juste titre : "Le mot français 'vitesse' est assez mal choisi pour désigner cette grandeur. Le terme anglais "rate of reaction" est peut-être moins ambigu"
Quel que soit le composant clé choisi pour la définition de la vitesse réactionnelle, il est toujours possible de décrire celle-ci par rapport aux autres composants. Ainsi, pour la réaction A + 2B = R :
rR = −rA = −0,5rB
