Loi de vitesse
La loi de vitesse d'une réaction chimique est une expression mathématique qui relie la vitesse réactionnelle à certains paramètres caractéristiques du système. Dans un milieu homogène, ces facteurs sont notamment :
-
les concentrations des réactifs. En effet, la réaction est d'autant plus rapide que les concentrations des réactifs sont grandes.
-
la température. Pour la quasi-majorité des réactions chimiques, une augmentation de la température accélère la vitesse réactionnelle.
Par conséquent, pour les réactions homogènes, la loi de vitesse prend le plus souvent la forme :
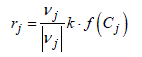
Dans cette expression le rapport νj/|νj| permet de se conformer à la convention des signes choisie pour la vitesse réactionnelle (positive si Aj est un produit et négative si c'est un réactif). k, appelé la constante de vitesse, tient compte du rôle de la température. L'influence des concentrations est incluse dans le terme f(Cj). Ce terme est une fonction plus ou moins complexe des concentrations mais l'expérience montre qu'il peut, dans de nombreux cas, se présenter sous forme :
Les αj peuvent être des nombres entiers ou fractionnaires généralement petits. Ils représentent les ordres partiels par rapport aux composants Aj correspondants. L' ordre global de la réaction Ω est défini par la somme des ordres partiels :
Pour une réaction chimique dont l'équation-bilan est A + B = R, la loi de vitesse obtenue expérimentalement est de type « -rA = k . CA . CB1,5. »
Nous pouvons en déduire que l'ordre partiel est de 1 par rapport à A, de 1,5 par rapport B et de 0 par rapport à R. L'ordre global est donc de 2,5.
Il est important de noter que la constante cinétique k d'une réaction chimique soit un paramètre dont les dimensions sont variables et fonction de l'ordre global de la réaction. En effet, d'après les équations (3-5) et (3-6), nous avons :
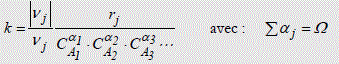
Or, la vitesse réactionnelle s'exprime en [mol.m-3.s-1], ceci quel que soit l'ordre de la réaction. Donc, la constante k doit s'exprimer en :
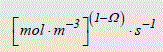
De même, connaissant les dimensions de k, il est toujours possible de déduire l'ordre global de la réaction.
-
Pour l'exemple précédent, l'ordre global étant égal à 2, k s'exprime en [mol-1.m3.s-1].
-
Pour une réaction quelconque, k vaut 0,1 [mol0,5.m-1,5.s-1]. L'ordre global de la réaction est de 1,5.
